Valenssisidoksen (VB) teoria on kemiallisen sitoutumisen teoria, joka selittää kemikaalin liimaus kahden välillä atomia. Samoin kuin molekyyliorbitaaliteoria (MO), se selittää sitoutumisen kvanttimekaniikan periaatteilla. Valenssisidosteorian mukaan sitoutuminen johtuu puoliksi täytetyn atomin päällekkäisyydestä orbitaalien. Kaksi atomia jaa toistensa pariton elektroni täytetyn kiertoradan muodostamiseksi hybridi kiertorata ja sidotaan yhteen. sigma ja pi-sidokset ovat osa valenssisidosteoriaa.
Keskeiset takeet: Valence Bond (VB) -teoria
- Valenssisidos- tai VB-teoria on kvanttimekaniikkaan perustuva teoria, joka selittää kuinka kemiallinen sidos toimii.
- Valenssisidosteoriassa yksittäisten atomien atomiorbitaalit yhdistetään kemiallisten sidosten muodostamiseksi.
- Toinen tärkein kemiallisen sitoutumisen teoria on molekyyliorbitaaliteoria tai MO-teoria.
- Valenssisidosteoriaa käytetään selittämään, kuinka kovalenttiset kemialliset sidokset muodostuvat useiden molekyylien välillä.
Teoria
Valenssisidosteoria ennustaa kovalenttisen sidoksen muodostumisen atomien välillä, kun niillä on puoliksi täytetyt valenssiatomiset kiertoradat, joista kukin sisältää yhden parittoman elektronin. Nämä atomiorbitaalit menevät päällekkäin, joten elektronilla on suurin todennäköisyys olla sidosalueella. Sitten molemmat atomit jakavat yhden parittoman elektronin heikosti kytkettyjen orbitaalien muodostamiseksi.
Kahden atomin kiertoradan ei tarvitse olla sama toistensa kanssa. Esimerkiksi sigma- ja pi-sidokset voivat olla päällekkäisiä. Sigma-sidokset muodostuvat, kun kahdella jaetulla elektronilla on kiertoalueet, jotka menevät päällekkäin. Sitä vastoin pi-sidokset muodostuvat, kun kiertoradat ovat limittäin, mutta ovat yhdensuuntaiset toistensa kanssa.
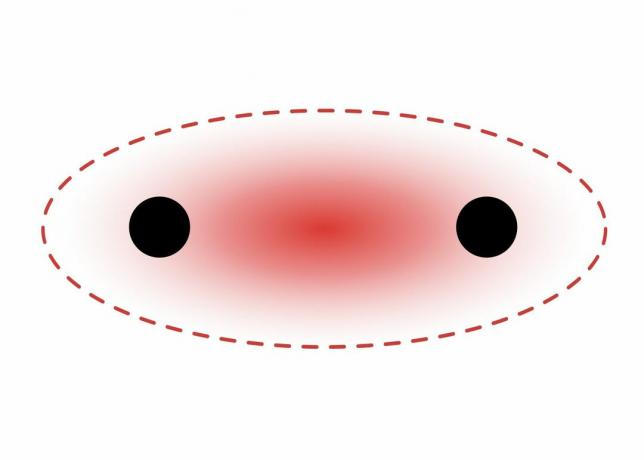
Sigma-sidokset muodostuvat kahden s-orbitaalin elektronien välillä, koska kiertorata on pallo. Yksittäiset sidokset sisältävät yhden sigma-sidoksen. Kaksoissidokset sisältävät sigma-sidoksen ja pi-sidoksen. Kolmoissidokset sisältävät sigma-sidoksen ja kaksi pi-sidosta. Kun atomien väliin muodostuu kemiallisia sidoksia, atomiorbitaalit voivat olla sigma- ja pi-sidosten hybridejä.
Teoria auttaa selittämään sidoksen muodostumista tapauksissa, joissa a Lewisin rakenne ei osaa kuvailla todellista käyttäytymistä. Tässä tapauksessa useita valenssisidosrakenteita voidaan käyttää kuvaamaan yhtä Lewisin rajoitusta.
Historia
Valenssisidosteoria perustuu Lewisin rakenteisiin. G. N. Lewis ehdotti näitä rakenteita vuonna 1916 perustuen ajatukseen, että kaksi jaettua sitoutumiselektronia muodostivat kemiallisia sidoksia. Kvanttimekaniikkaa käytettiin kuvaamaan sidosominaisuuksia Heitler-London-teoriassa vuonna 1927. Tämä teoria kuvasi kemiallisen sidoksen muodostumista vetyatomien välillä H2-molekyylissä käyttämällä Schrödingerin aaltoyhtälöä kahden vetyatomin aaltofunktioiden yhdistämiseksi. Vuonna 1928 Linus Pauling yhdisti Lewisin pariliitosidean Heitler-Lontoo-teoriaan ehdottaakseen valenssisidosteoriaa. Valenssisidosteoria kehitettiin kuvaamaan resonanssia ja kiertoradan hybridisaatiota. Vuonna 1931 Pauling julkaisi valenssisidosten teoriaa käsittelevän kirjan "Kemiallisen sidoksen luonteesta". Ensimmäiset käytetyt tietokoneohjelmat kuvaamaan käytettyä molekyyliorbitaaliteoriaa, mutta 1980-luvulta lähtien valenssisidoksen teoriasta on tullut ohjelmoitava. Nykyään näiden teorioiden nykyaikaiset versiot kilpailevat toistensa kanssa todellisen käyttäytymisen kuvaamiseksi tarkasti.
käyttötarkoitukset
Valenssisidosteoria voi usein selittää kuinka kovalenttiset sidokset muodostavat. kaksiatomiseksi fluorimolekyyli, F2, on esimerkki. Fluoriatomit muodostavat yhden kovalenttisen sidoksen toistensa kanssa. F-F-sidos johtuu päällekkäisyyksistä pz kiertoradat, joissa kukin sisältää yhden parittoman elektronin. Samanlainen tilanne tapahtuu vedyssä, H2, mutta sidoksen pituudet ja lujuus ovat erilaisia H: n välillä2 ja F2 molekyylejä. Kovalenttinen sidos muodostuu vedyn ja fluorin välillä fluorivetyhapossa, HF. Tämä sidos muodostuu vedyn 1 päällekkäisyydestäs kiertorata ja fluori 2pz kiertorata, joissa molemmissa on parittomat elektronit. HF: ssä sekä vety- että fluoriatomit jakavat nämä elektronit kovalenttisessa sidoksessa.
Lähteet
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "Bentseenimolekyylin elektroninen rakenne." luonto. 323 (6090): 699. doi:10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "Bentseenimolekyylin elektroninen rakenne." luonto. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedder, J. M. (1985). Kemiallinen sidos (2. painos). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Bentseenimolekyylin elektroninen rakenne." Nature. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). Kemikaaliopas Valence Bond -teoriaan. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.